*Эрстекис А.Г., *Калиш Ю.И., **Москвин С.В.
* – Республиканский специализированный центр хирургии им. акад. В.Вахидова (дир. – проф. Ф.Г. Назыров), г. Ташкент, Республика Узбекистан,
** – ФГУ «ГНЦ лазерной медицины ФМБА России», г. Москва
Искусственное кровообращение является одним из самых молодых и динамически развивающихся разделов медицины. Каждый год в мире проводятся сотни тысяч успешных операций на открытом сердце в условиях искусственного кровообращения (ИК).
Несмотря на совершенствование аппаратов и оксигенаторов для проведения ИК, не удалось окончательно решить всех проблем и осложнений, связанных с проведением ИК. Изучение методик проведения ИК, в частности, влияния низкоинтенсивного лазерного излучения (НИЛИ) при проведении экстракорпорального кровообращения на клетки крови, метаболизм тканей и органов является одной из важных задач.
За последние 10 лет, по мере накопления знаний по патофизиологии ИК, совершенствования технологии перфузии и появления новых аппаратов искусственного кровообращения (АИК), оксигенаторов, препаратов для заполнения оксигенатора, все большее внимание уделяется осложнениям, связанным с проведением ИК.
Степень изученности проблемы ИК и влияния НИЛИ на клетки крови при проведении ИК не охватывает исследование гемолиза (разрушения) эритроцитов, являющихся основными клетками крови, переносящими О2 в органы и ткани, а также исследования кислотно-основного состояния (КОС), лактата крови, как наиболее достоверного показателя гипоксии при проведении ИК, что и привело к проведению данной исследовательской работы.
Гемолиз является одним из осложнений проведения длительного ИК.
В 1969 г. Peirce были определены факторы во время проведения искусственного кровообращения вызывающие гемолиз:
- воздействие насоса;
- силы поверхностного натяжения в пузырьковых оксигенаторах;
- силы сдвига, возникающие благодаря внезапным изменениям площади поперечного сечения канюль и трубок;
- струйные силы, возникающие при высокой скорости движения клеток крови.
Модификация АИК, оксигенаторов, создание биосовместимых покрытий – все это не смогло полностью решить проблему гемолиза при проведении ИК.
Органами, наиболее чувствительными к изменениям содержания и доставки кислорода в клетку, являются мозг, печень, почки, миокард.
Причины нарушения кислородного статуса организма можно разделить на две группы:
1. гемодинамические или дыхательные расстройства;
2. нарушения химических процессов в клетках.
При нарушении кислородного баланса в организме накапливаются недоокисленные продукты, главным образом, молочная кислота, которая моментально разлагается на ионы водорода и лактат.
В нормальных условиях в клетках происходит аэробный метаболизм, при достаточном количестве кислорода метаболизм глюкозы, при этом глюкоза окисляется в цикле Кребса до СО2 и Н2О, образуя 36 молекул АТФ, что определяет достаточный энергетический уровень для обменных процессов в клетке. При таком физиологическом процессе показатель лактата крови в организме находится в пределах 0,8-1,6 ммоль/л, что является нормой. Образующийся при этом лактат метаболизируется различными органами и лишь единично экскретируется с мочой (табл. 1).
Таблица 1. Утилизация лактата в организме в условиях нормы.
| Органы, метаболизирующие лактат | Соотношение лактата в % от общего содержания в крови |
| Печень | 50% |
| Почки | 25-30% |
| Сердце | 20-25% |
Из таблицы 1 видно, что органами, метаболизирующими лактат, являются печень, сердце, почки. Совершенно очевидно, что на фоне дефицита кислорода и последовательно развивающейся полиорганной недостаточности роль этих органов в снижении концентрации лактата значительно ослабевает. Таким образом, концентрация лактата в крови постоянно увеличивается, указывая на нарушение кислородного обмена и циркуляторной гипоксии в организме. На фоне недостатка кислорода углеводный метаболизм в клетке резко нарушается, что сопровождается накоплением молочной кислоты и выходом ее в кровь, а также резким снижением энергетических возможностей клетки. Данный компенсаторный механизм анаэробного окисления глюкозы и выброса лактата в кровь сигнализирует о метаболических нарушениях в тканях и органах и тем самым указывает перфузиологу на необходимость мер по улучшению качества проведения перфузии.
Материалы и методы исследования
С августа 2009г. по март 2010г. в Республиканском Специализированном Центре Хирургии им. акад. В. Вахидова, в отделении врожденных пороков сердца (ВПС) проведено 47 операций в условиях ИК больным с тяжелыми формами ВПС, из них в 17 случаях во время перфузий применяли низкоинтенсивное лазерное излучение. Длительность ИК в обеих группах была от 150 до 360 мин, в среднем 167±21 мин ИК проводилось на аппарате “Stokcert” (Германия) и оксигенаторах “Dideco”(Италия).
Таблица 2. Распределение больных по группам
| Группы Параметры |
I группа | II группа (НИЛИ) |
| Возраст, лет | 11,7±1,01 | 12,3±0,79 |
| Пол, М/Ж | 16/14 | 10/7 |
| Вес (ср.зн.), кг | 29,5±1,98 | 33,3±1,68 |
| Рост (ср.зн.), см | 135,1±3,67 | 143,3±2,66 |
| Sм²-тела | 1,0±0,05 | 1,1±0,04 |
Примечание: р<0,5 между группами.
Исходное состояние пациентов по данным лактата и глюкозы крови было в пределах нормы. Хочется отметить, что средний возраст больных составил от 11 до 13 лет, соответственно, все параметры, такие как вес, рост, необходимые для расчетов объемной скорости перфузии, практически достоверно схожи.
При проведении ИК одним из показателей разрушения эритроцитов крови является появление свободного гемоглобина в крови. В процессе проведения искусственного кровообращения нами проводилось исследование свободного гемоглобина по методу Кушакова-Ивченко. Данный метод заключается в следующем: в пробирку поместить 4 мл HCl и 0,1 мл сыворотки (или мочи), перемешать. Через 10 мин измерить оптическую плотность. В норме 10% эритроцитов разрушаются в сосудистом русле (90% – внутриклеточно, в селезенке) с поступлением в кровь свободного гемоглобина (Hb). Этот Hb соединяется с гаптоглобином, образует гемоглобин-гаптоглобиновый комплекс, который не проходит через почечный фильтр, а, поступив в печень, селезенку и костный мозг, разрушается. В норме гаптоглобин может связать до 1 г/л свободного Hb – это «почечный порог» для свободного Hb. При уровне свободного Hb выше 1 г/л он выделяется через почки, превращаясь в гемосидерин, который выводится с мочой в виде Hb (гемоглобинурия), цвет мочи темно-красный, коричневый.
Степень гемолиза: 0,5-1,5 – легкая, в моче нет; 1,5-3,5 – средняя, есть; 3,5-10 – тяжелая, большое кол-во; >10 – часто летальный исход.
Заборы крови для исследования гемолиза проводились каждые 60 мин во время проведения ИК и после окончания операции до нормализации.
Таблица 3. Исходные показатели лабораторного исследования крови в группах.
| Показатели | I группа (n=30) | II группа (n=17) (НИЛИ) |
| Лактат, ммоль/л | 1,2±0,14 | 1,1±0,04 |
| Глюкоза, ммоль/л | 5,4±0,21 | 5,1±0,14 |
| Hb, г/л | 165,2±4,39 | 169,5±4,09 |
| Ht, % | 49,6±1,32 | 50,8±1,23 |
Примечание: р<0,5 между группами.
Пациенты в обеих группах подбирались с гематокритом более 160 г/л в исходном состоянии, наиболее тяжелые формы ВПС (тетрада Фалло, двойное отхождение магистральных сосудов (ДОМС), тотальный аномальный дренаж легочных вен (ТАДЛВ).
Для проведения внутривенного лазерного облучения крови (ВЛОК) использовали аппарат «Матрикс-ВЛОК» с излучающей головкой КЛ-ВЛОК-405. Облучение НИЛИ длиной волны 405 нм (0,405 мкм), мощностью 1,5мВт проводилось в течение 7 мин в приточной (венозной) линии оксигенатора. После проведения облучения каждые 30 мин брали артериальную и венозную кровь на исследование КОС, электролитов, лактата, глюкозы, билирубина крови и каждые 60 мин на гемолиз эритроцитов крови в обеих исследуемых группах.
При оценке эффективности воздействия ВЛОК-405 учитывали состояние гемодинамики, метаболизма, исследования анализов, диуреза и гемолиза эритроцитов при проведении ИК.
Для оценки кислородного статуса пациента в настоящем исследовании использовали концепцию датского ученого O.Siggaard Andersen (1990) <>. Она позволяет верифицировать степень поглощения кислорода в легких (рО2), транспорт кислорода кровью (ctO2) и высвобождение кислорода в ткани (р50). Анализы крови производились на аппарате ABL-735 фирмы «Radiometer», (Дания): до начала ИК, на 5 мин ИК, каждые 30 мин во время всего ИК, после облучения НИЛИ, перед вывозом больного из операционной и по мере необходимости в реанимации.
В первичный объем оксигенатора при необходимости (в тех случаях, когда ожидаемый гематокрит на ИК был ниже 18%) добавлялись препараты крови (в основном – трижды отмытые эритроциты).
Перфузионный индекс во всех группах колебался от 2,5 до 3,5 л/мин/м². При необходимости (высоком показателе Ht) производился забор аутокрови, как правило, или до начала, или на начало ИК по формуле (1):
![]() (1)
(1)
где Htб – гематокритное число перед гемодилюцией (Нt больного),
Htн – гематокритное число, ожидаемое после гемодилюции,
V – ОЦК больного,
Vд – допустимый объем отбора крови.
В процессе ИК мы проводили гемодилюцию при помощи следующих манипуляций:
1. Аутозабор крови проводится до начала ИК в необходимом количестве для получения нужного значения гемодилюции, при этом восполняя ОЦК путем вливания коллоидных растворов и коррекции состава всех необходимых микроэлементов.
2. Проведение забора крови с венозной или артериальной линии на начало ИК. При этом в оксигенатор параллельно вливаются коллоидные и корригирующие растворы (сода, калий, кальций и др.) для достижения необходимого значения гемодилюции.
3. Разведением коллоидными и кристаллоидными препаратами на любом этапе операции, как с забором аутокрови, так и без него.
Для получения нужной степени гемодилюции крови у больных с высоким Нt применяли следующую формулу (2):
![]() (2)
(2)
где Vk – объем кровозаменителя в л,
М – масса больного в кг,
Va – заправочный объем оксигенатора в л,
Htб – гематокритное число больного в % до перфузии,
Htик – гематокритное число больного в % во время перфузии.
К концу проведения ИК, в случаях, когда производился забор аутокрови, она полностью возвращалась пациенту до момента остановки перфузии, а кровь из оксигенатора после остановки ИК вытеснялась физиологическим раствором в аорту под контролем давления в левом предсердии.
Артериальное давление при проведении ИК поддерживалось в пределах 40-60 мм.рт.ст. На этапе перехода от искусственного кровообращения к естественному стабилизировали гемодинамику АД не менее 90/50 мм.рт.ст., а также показатели ЦВД, сердечный ритм, газы крови, КОС, электролиты. Адекватность перфузии оценивали по показателям кислотно-основного состояния, содержания лактата в крови, газового и электролитного состава крови, темпа выделения мочи, кожно-ректального или пищеводно-ректального температурного градиента, данными артериального давления при проведении ИК, а также по показателю гемолиза эритроцитов как одного из основных показателей разрушения эритроцитов.
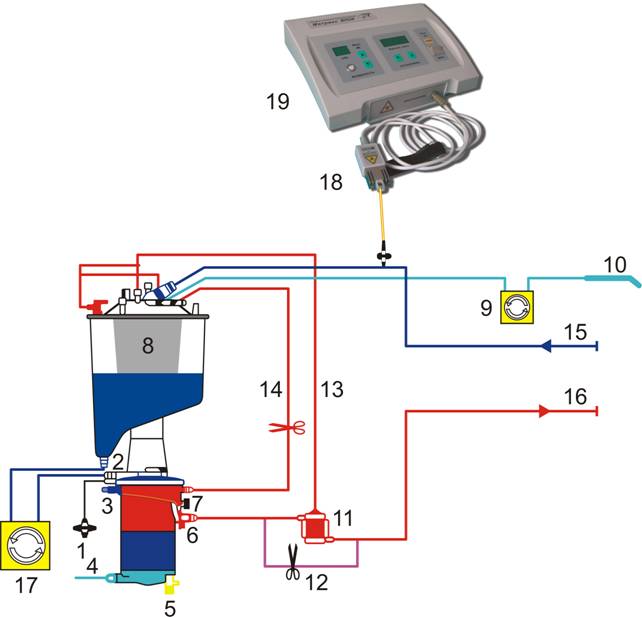
Рис. 1. Схема контура проведения экстракорпорального кровообращения и лазерного облучения крови ВЛОК-405.
- Фильтр газа.
- Вход в оксигенатор 3/8 дюйма.
- Температурный порт.
- Вход и выход теплообменника 1/2 соединение Хансена.
- Выход газа.
- Выход из оксигенатора 3/8 дюйма.
- Резервный выход для кровяной кардиоплегии 1/4 дюйма.
- Жесткий венозный резервуар.
- Насос аппаратного отсоса (насосный сегмент 1/4 дюйма).
- Аппаратный отсос 1/4 дюйма.
- Артериальный фильтр-ловушка.
- Шунт фильтра-ловушки.
- Рециркуляционный шунт фильтра-ловушки 1/16 дюйма.
- Рециркуляционный шунт оксигенатора 1/4 дюйма.
- Венозная магистраль 1/2 дюйма.
- Артериальная магистраль 3/8 дюйма.
- Артериальный насос (насосный сегмент 1/2 дюйма).
- Лазерная излучающая головка ВЛОК-405.
- Аппарат лазерный терапевтический «Матрикс-ВЛОК».
Результаты исследования
При исследовании состояния больных во время проведения ИК и в раннем послеоперационном периоде выявлено, что в группе с применением НИЛИ при проведении ИК показатели газов крови, рН, ВЕ, электролитный состав, глюкоза, лактат, находились в более стабильном состоянии и нуждались в меньшей коррекции с использованием 4% бикарбоната в среднем на 20%. Лактат крови не выходил за пределы в среднем 2,4 ммоль/л даже при длительности ИК более 300 мин. Свободный гемоглобин (гемолиз) в группе с применением НИЛИ с длиной волны 405 нм, мощностью облучения 1,5 мВт, длительностью воздействия 7 мин, наступал только после 280 мин ИК и к 300-360 мин ИК не превышал в среднем 1,7±0,1 г/л. Тогда как в группе без облучения уже к 180 мин гемолиз был в среднем 2,5±0,1 г/л и к 360 мин проведения ИК составлял в среднем 2,9±0,1 г/л. Данный эффект воздействия НИЛИ с длиной волны 405 нм объясняется влиянием излучения на мембрану эритроцитов, а именно на липидную оболочку и улучшением ее эластических качеств.
Таблица 4. Значения гематокрита при проведении ИК в группах
| Группы | Этапы | Ht, % |
| I гр. (n=30) | Исход | 49,6±1,32 |
| Середина | 28,7±0,74 | |
| Конец | 31,7±0,69 | |
| II гр. (n=17) (НИЛИ) | Исход | 50,8±1,23 |
| Середина | 30,0±0,64 | |
| Конец | 32,4±0,58 |
Примечание: р<0,5 между I гр. и II гр. во время ИК
Кислородная емкость крови (КЕК) при проведении ИК снижалась в обеих группах в связи с гемодилюцией и снижением гематокрита (табл. 4). К концу искусственного кровообращения значения кислородной емкости восстанавливались до 65-75% от исходного состояния в обеих группах, однако во второй группе были максимальные показатели.
Таблица 5. Сравнение КЕК при проведении ИК между группами
| Группы | Этапы | КЕКа | КЕКв |
| I группа (n=30) | Исход | 188,6±5,32 | 145,5±5,05 |
| Середина | 115,3±3,28 | 96,9±3,79 | |
| Конец | 126,6±3,07 | 99,8±4,02 | |
| II группа (n=17) (НИЛИ) | Исход | 189,6±5,30 | 146,1±5,0 |
| Середина | 120,9±2,85 | 100,3±3,04 | |
| Конец | 131,0±2,60 | 104,9±2,57 |
р<0,05 между I гр. и II гр. во время ИК
В процессе проведения ИК значения в группах соответствуют гемодилюции, и из данных КЕКа.в., АВР, DO2I, VO2I видно, что при сохранении необходимой объемной скорости и гемоглобина КЕКа.в., АВР, DO2I, VO2I, во всех группах снижается.
На момент искусственного кровообращения идет снижение артериовенозной разницы (АВР), что видно из таблицы 6. При этом, сравнивая с динамикой лактата крови, видна взаимосвязь снижения АВР и КЕК на момент согревания больного.
Таблица 6. Сравнение АВР между группами
| Группы | Исход | Середина ИК | Конец ИК |
| I группа (n=30) | 43,1±2,53 | 18,4±1,77 | 26,7±1,91 |
| II группа (n=17) (НИЛИ) | 43,5±2,27 | 27,6±1,10 | 35,0±1,43 |
Примечание: р<0,05 между I гр. и II гр. во время ИК
Из данных таблиц 5 и 6 видно, что с началом проведения ИК происходит уменьшение КЕКа.в., АВР, DO2I, VO2I в обеих группах. Это объясняется гемодилюцией в связи с разведением ОЦК и гемоглобина крови пациентов.
После проведения облучения ВЛОК-405 наблюдается постепенное улучшение показателей метаболизма в группе с применением ВЛОК-405 и гемолиза эритроцитов, особенно это проявляется после 120 мин ИК. Данное состояние качества эритроцитов и организма пациента при проведении перфузии объясняется воздействием ВЛОК-405 на мембрану эритроцитов и улучшение ее пластических (эластических) качеств, что приводит к сохранению самого эритроцита и сохранению кислородно-транспортной емкости крови. Данные по определению гемолиза подтверждаются данными КОС и лактата крови, что доказывает лучший метаболизм во второй группе. Одним из достоинств проведения данной экстракорпоральной (не инвазивной) методики лазерного облучение является абсолютная защищенность от заражения инфекциями передающимися через кровь (гепатиты “В”, “С”, СПИД и др.), так как нет соприкосновения с кровью пациента каких-либо частей аппарата. В послеоперационном периоде у больных в группе с лазерным облучением не наблюдалось инфекционных осложнений, что также доказывает и положительный бактерицидный эффект данной методики.
При сопоставлении изменений метаболизма тканей и органов с анализом лактата также видно максимальное содержание лактата к концу ИК в первой группе до 3,1±0,3 ммоль/л (к 360 мин ИК). После остановки ИК в обеих группах наблюдается увеличение КЕКа.в., АВР, DO2I, VO2I, но во второй группе лактат не превышал значения в среднем 2,4±0,2 ммоль/л (к 360 мин ИК).
При сопоставлении показателей газов крови отмечается стойкое низкое содержания рСО2 в артериальной и венозной крови в первой группе, что неблагоприятно в связи с влиянием данного показателя на церебральный кровоток. При анализе каждой группы в отдельности видно, что наиболее благоприятные показатели КЕК, АВР, DO2I, VO2I, а также показатели КОС были во второй группе. Это также подтверждается хорошими значениями лактата крови, который минимален на конец ИК во второй группе и не выходит в среднем за пределы 2,4±0,2 ммоль/л.
Таблица 7. Средние показатели индекса потребления кислорода в группах (VO2I)
| Группы | Исход | Середина ИК | Конец ИК |
| I группа | 19,5±10,57 | 47,0±9,34 | 69,0±6,12 |
| II группа | 120,2±7,57 | 57,3±3,44 | 93,65±4,81 |
Примечание: р<0,05 между I гр. и II гр. во время ИК
Сравнивая показатели лабораторных исследований первой и второй групп видно, наилучшие результаты во второй группе, что доказывается показателями более низкого лактата крови и гемолиза эритроцитов, а также показателями кислородного статуса как во время проведения ИК, так и в раннем послеоперационном периоде.
Таблица 8. Показатели гемолиза во время проведения ИК в группах
| Группы | Исход | 120 мин. | 180 мин. | Более 180 мин. | После ИК через 180 мин. |
| I группа | 1,2±0,5 | 2,0±0,5 | 2,5±0,6 | 2,9±0,7 | 1,8±0,8 |
| II группа | 1,2±0,7 | 1,5±0,9 | 1,7±0,5 | 1,9±0,9 | 1,4±0,8 |
| Р | >0,5 | >0,1 | <0,05 | <0,05 | <0,05 |
Полученные данные исследования в обеих группах подтверждают временной фактор, как основной фактор воздействия на форменные клетки крови, в частности, на эритроциты. Представленные в таблице 8 показатели гемолиза свидетельствуют о том, что в первые 60 минут ИК гемолиз незначителен во всех исследуемых группах, с незначительным увеличением в первой группе.
Постепенное увеличение гемолиза наступает в обеих группах, что связано с длительностью проведения ИК. Вместе с тем, у пациентов второй группы показатель гемолиза ниже.
Выводы
Применение при кардиохирургических операциях на этапе проведения искусственного кровообращения НИЛИ с длиной волны 405 нм, мощностью 1,5 мВт, время облучения 7 мин, улучшает стойкость мембраны эритроцитов к воздействию роликового насоса АИК и ЭКК у больных тяжелыми формами ВПС. Благодаря этому эффекту улучшается как метаболизм тканей и органов, за счет хорошего переноса О2, так и функциональная способность внутренних систем организма (сердечно-сосудистая, гемостатическая, неврологическая и др.), что проявляется в постперфузионном периоде в операционной и в послеоперационном периоде в реанимации. Положительный эффект на форменные элементы НИЛИ с длиной волны 405 нм крови дает возможность проводить более длительные перфузии у больных с тяжелыми формами ВПС наиболее физиологично и с наименьшими осложнениями. Подтверждением данных эффектов НИЛИ с длиной волны 405 нм является низкий уровень лактата крови, который во второй группе не превышал 2,4 ммоль/л, тогда как в группе без применения лазерного облучения он достигал в среднем 3,1 ммоль/л; гемолиз эритроцитов также был выше в первой группе.